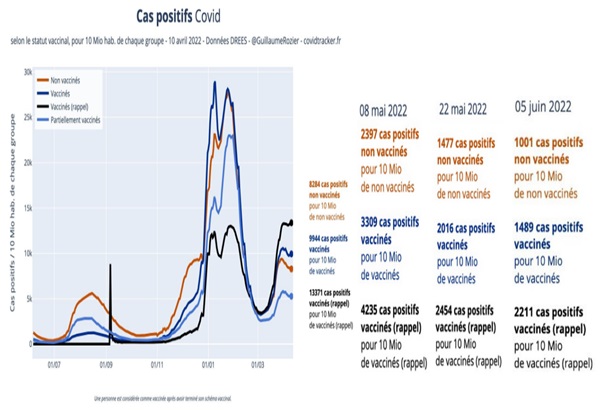
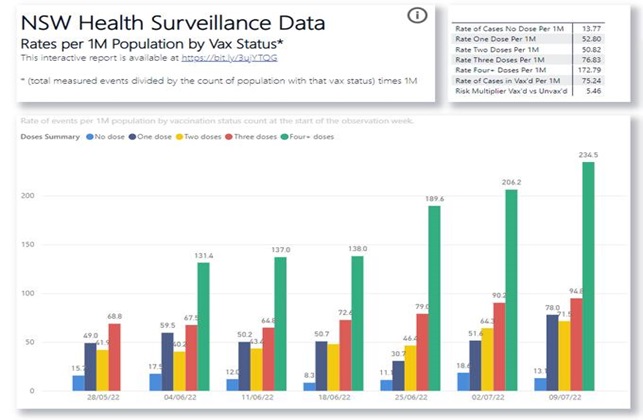
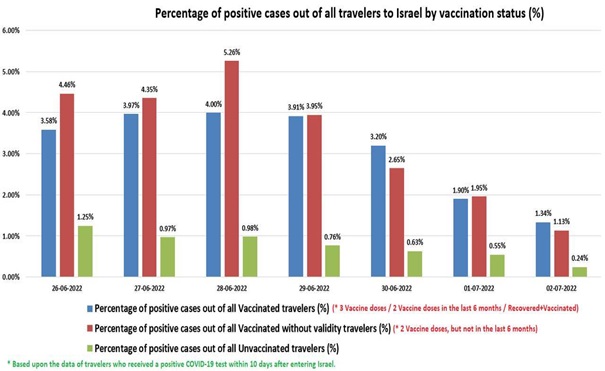
Les progrès considérables réalisés en matière de santé publique au cours du siècle dernier sont largement attribués à l’introduction progressive de nombreux vaccins, qui ont contribué à contrôler, voire à éradiquer, les maladies infectieuses les plus graves et les plus courantes, en particulier celles qui touchent les enfants. En raison de ses succès passés, la vaccination est devenue une stratégie de santé publique tellement dominante qu’il est pratiquement impossible de discuter calmement de ses inconvénients potentiels au sein de la communauté scientifique. Dans le même temps, le public se méfie de plus en plus des vaccins, en particulier des derniers vaccins à base d’ARNm, les réseaux sociaux rapportant spontanément un nombre croissant d’effets indésirables très divers. Compte tenu du manque de fiabilité de ces rapports, de leur extrême diversité et de l’absence de preuve de causalité, il est extrêmement difficile de déterminer s’il s’agit réellement d’effets indésirables de la vaccination ou de simples coïncidences. Pourtant, l’incidence des maladies chroniques ne cesse d’augmenter, des plus bénignes (allergies) aux plus graves (maladies neurodégénératives, cancers agressifs), en passant par des affections strictement individuelles et déroutantes. Dans cet article, sans prendre position sur l’origine ni même la réalité de ces problèmes de santé, nous proposons une hypothèse théorique qui, sur la base de nos connaissances actuelles en immunologie, pourrait remettre en question l’innocuité généralement admise de la vaccination. Selon cette hypothèse, l’extrême individualité de la réponse immunitaire, associée à la fréquence des réactions auto-immunes, pourrait déclencher des pathologies « privées » extrêmement diverses, dont la fréquence de reproductibilité pourrait être trop faible pour en déduire une causalité.
article traduit de Jean-Michel Claverie
https://www.preprints.org/manuscript/202508.0632
Introduction
Les progrès considérables réalisés en matière de santé publique au cours du siècle dernier sont traditionnellement attribués à l’introduction progressive de nombreux vaccins, qui ont contribué à contrôler, voire à éradiquer, les maladies infectieuses les plus graves et les plus courantes, en particulier celles qui touchent les enfants [1,2]. Compte tenu de ses succès passés, la vaccination est désormais devenue la panacée incontestée contre les maladies infectieuses et un paradigme médical qu’il est pratiquement impossible de critiquer dans la plupart des pays occidentaux sans être taxé de complotiste [3,4], en particulier pour les professionnels de santé [5,6].
Cependant, la gestion autoritaire de la récente épidémie de Covid-19 et les politiques de santé publique parfois maladroites et agressives en faveur des vaccins [7], associées à la précipitation inhabituelle avec laquelle les vaccins à ARNm les plus récents ont été mis sur le marché [8,9,10] ont entraîné une augmentation de la réticence à la vaccination, alimentée par les rapports continus de nouveaux effets indésirables sur les réseaux sociaux [11,12]
Parallèlement, des rapports de cas déroutants, dont la plupart ont malheureusement été publiés dans des revues à faible impact, ont commencé à s’accumuler dans la littérature. Dans l’ensemble, ces rapports sont ignorés (voire ridiculisés) par les autorités médicales, au motif que la plupart de ces soi-disant effets indésirables semblent à la fois étranges et strictement individuels [voir par exemple [13,14,15,16,17]]. S’il est difficile de distinguer les rapports fantaisistes de ceux qui décrivent des troubles réels post-vaccinaux, il est encore plus illusoire de prouver leur lien de causalité en raison de leur non-reproductibilité. À l’exception des plus immédiats (par exemple, les réactions allergiques) ou des plus récurrents [par exemple, [18,19,20,21,22] ] pour lesquels un signal statistique est attendu dans les études portant sur une large population [23,24], il est impossible d’éliminer le doute dans les cas d’effets indésirables pratiquement uniques.
Dans cet article, plutôt que de spéculer sur la réalité de ces effets indésirables individuels si divers, nous posons plutôt la question suivante : qu’ils soient réels ou non, sont-ils au moins compatibles avec la réponse immunitaire telle que nous la connaissons ?
Répondre par l’affirmative m’amène à émettre l’hypothèse inquiétante selon laquelle les vaccins pourraient fréquemment déclencher des réactions auto-immunes générant des affections dont l’extrême diversité rend impossible, pour des raisons statistiques, d’en attribuer la cause au vaccin. Seuls les effets secondaires les plus récurrents (c’est-à-dire courants), mais qui devraient être rares compte tenu de l’individualité de la réponse immunitaire, seraient détectables, ce qui conférerait à tort à la vaccination sa réputation incontestée d’extrême sécurité.
Le fondement scientifique solide de cette hypothèse (certes provocatrice) devrait justifier un réexamen approfondi des avantages de la vaccination généralisée de la population, à un moment où la tendance est à son introduction contre des maladies moins fréquentes ou moins mortelles, ou en remplacement de traitements curatifs médicamenteux établis [par exemple, [25,26]].
La réponse immunitaire adaptative : principales caractéristiques
La présentation de mon hypothèse nécessite des connaissances de base en immunologie moléculaire et sur les principes fondamentaux régissant la réponse immunitaire adaptative. Cette section s’adresse donc aux lecteurs qui n’ont aucune connaissance préalable en immunologie.
La réponse immunitaire adaptative est la réaction de défense de l’organisme à la détection de macromolécules spécifiques (principalement des protéines) reconnues comme étrangères (c’est-à-dire « non-soi »), provenant soit de pathogènes microbiens, soit de protéines propres modifiées (par exemple, provenant de cellules cancéreuses mutées). Toute molécule capable de déclencher une telle réponse immunitaire spécifique est appelée « antigène ».
Cette réponse immunitaire est assurée par deux types de globules blancs circulants, engagés dans un réseau d’interactions complexes modulées de manière différentielle par la présence d’un ensemble hétérogène de protéines solubles, appelées interleukines (au nombre de 37 à l’heure actuelle) [27].
Un ensemble est constitué des cellules présentatrices d’antigènes (APC) (parmi lesquelles les macrophages, les cellules dendritiques et les cellules B) dont le rôle est de transformer les antigènes en fragments qui sont exposés à leur surface.
Le deuxième ensemble est constitué de lymphocytes spécialisés (cellules T) dont le rôle est de reconnaître ces antigènes et de déclencher et/ou d’exécuter différentes réponses. Par exemple, les cellules T cytotoxiques CD8+ détruisent les cellules portant l’antigène reconnu, tandis que les cellules T auxiliaires CD4+ transmettent un signal prolifératif, par exemple aux cellules B productrices d’anticorps.
Les deux types de réponses immunitaires adaptatives (cytotoxicité et production d’anticorps) sont donc médiés par le même processus central, à savoir la formation d’un pont peptidique entre une cellule porteuse d’antigène et un lymphocyte T. Cependant, cette simplicité conceptuelle cache des détails moléculaires qui sont à l’origine même de notre individualité biologique (et, en particulier, de notre incapacité à tolérer les greffes entre nous).
Présentation de l’antigène : deux types différents de molécules du CMH interagissant avec deux types différents de lymphocytes T
Il existe deux types de molécules MHC (pour Major Histocompatibility Complex, ou complexe majeur d’histocompatibilité), assez similaires en termes de structure et de fonction, mais qui remplissent des rôles physiologiques différents. Les molécules MHC de classe 1 se trouvent à la surface de tous les types de cellules nucléées, où elles présentent des fragments peptidiques dérivés de protéines synthétisées intracellulairement, qu’il s’agisse de protéines « propres » normales ou de protéines étrangères produites par des agents pathogènes infectieux (généralement des virus).
La reconnaissance des peptides présentés par le CMH de classe 1 est limitée aux lymphocytes T cytotoxiques portant le corécepteur CD8 (lymphocytes T CD8+). Ces peptides (épitopes des cellules T restreints à la classe 1) ont généralement une longueur de 9 ou 10 acides aminés [28].
En revanche, les molécules MHC de classe II ne sont exprimées que sur les cellules présentatrices d’antigènes (APC) professionnelles, telles que les macrophages, les monocytes, les cellules dendritiques et les cellules B, et présentent des fragments peptidiques dérivés de sources exogènes internalisées. La reconnaissance des peptides présentés par le MHC de classe II est limitée aux lymphocytes T porteurs du corécepteur CD4 (lymphocytes T « auxiliaires » CD4+). Les peptides présentés par le CMH de classe II sont donc essentiels pour le déclenchement de la réponse immunitaire (humorale) produisant des anticorps. Ces épitopes des lymphocytes T restreints au CMH de classe 2 ont une longueur de 12 à 20 acides aminés [29].
Il existe trois paires de gènes MHC de classe 1 chez l’être humain (HLA-A, HLA-B et HLA-C) et trois paires de gènes MHC de classe II (HLA-DR, HLA-DP et HLA-DQ) (HLA : Human Leukocyte Antigen). Chacune de ces protéines de surface est capable de se lier à différents répertoires de peptides partageant des acides aminés identiques (ou similaires) à deux positions « d’ancrage » (généralement près des extrémités du peptide). Le répertoire de peptides vaste et très diversifié présenté au système immunitaire d’un individu donné constitue son « immunopeptidome » (revue dans [30]).
Les gènes codant pour le CMH/HLA sont hautement polymorphiques.
Pour un isotype donné (par exemple, HLA-A) et un allèle donné (par exemple, HLA-A∗02:07), le répertoire peptidique mono-allélique peut comprendre jusqu’à 3 500 peptides « propres » uniques [31]. Un individu entièrement hétérozygote (exprimant 3 allèles HLA de classe 1 et 3 allèles HLA de classe 2 différents) devrait donc présenter jusqu’à 21 000 peptides différents pour chaque classe.
Il est important de noter que la présentation de ces peptides constitue la base de la discrimination immunologique entre le soi et le non-soi, en provoquant la suppression des lymphocytes T autoréactifs, d’abord lors de leur maturation initiale dans le thymus, puis plus tard par contact avec les cellules dendritiques tolérogènes périphériques [32].
Comme la taille de ce peptidome propre est approximativement égale au nombre total de protéines codées dans le génome humain [33], cela laisse théoriquement présager que chaque protéine humaine ne sera représentée en moyenne que par un ou deux peptides. En réalité, une fraction beaucoup plus petite du protéome humain est criblée, car une grande partie des peptides présentés proviennent uniquement de protéines abondantes et/ou à renouvellement rapide (certaines représentant plus de 1 % du total).
Ces chiffres suggèrent également que l’auto-immunopeptidome n’est pas suffisamment vaste pour inclure les peptides provenant des jusqu’à 200 000 ARNm humains épissés de manière alternative [33]. Par conséquent, une mutation ou un changement transitoire du niveau d’expression ou du traitement de l’ARNm d’un gène peut potentiellement déclencher une réponse auto-immune suite à la reconnaissance d’un nouveau peptide propre à l’organisme en raison de l’absence de tolérance des cellules T apparentées (telles que les cellules T cytotoxiques CD8+). Ainsi, seul un ensemble partiel de protéines humaines participe à la définition de l’auto-immunité par le biais de sa sélection par les allèles HLA de classe 1 et de classe 2 exprimés par chaque individu.
Par exemple, les analyses des immunopeptidomes de 18 individus ont révélé que les peptides liés à 27 molécules HLA-I très répandues provenaient de seulement 10 % du génome exprimé [34]. D’autres études indiquent un peptidome total associé à HLA-1 ne dépassant pas 5 500 peptides [35]. Cela laisse une place importante dans la définition du soi peptidique, ouvrant ainsi largement la possibilité d’une autoréactivité.
Bien que défini de manière approximative, ce « soi-peptide » [36] est très variable et propre à chaque individu en raison du polymorphisme extrême des molécules présentées : jusqu’à 200 allèles pour chacun des loci HLA, chaque allèle étant présent à une fréquence relativement élevée dans la population. Il existe donc des millions de combinaisons HLA possibles, générant des immunopeptidomes distincts qui fournissent à chacun d’entre nous un paysage privé du protéome humain, malgré sa conservation élevée au sein de la population humaine (variations moyennes de 0,6 % des paires de bases, dont la plupart sont silencieuses) [37].
Ainsi, si nous appartenons tous à la même espèce et sommes constitués de protéines extrêmement similaires, la vision du « soi » présentée au système immunitaire est propre à chaque individu au sein de la population. La frontière entre le soi et le non-soi est donc cartographiée différemment chez chacun d’entre nous, délimitée de manière dynamique par le système immunitaire de chaque individu.
Dans le contexte de notre moi privé, une infection par un agent pathogène donné (ou un vaccin qui l’imite) entraînera également la présentation de sous-ensembles distincts de peptides étrangers, fournissant à chaque système immunitaire individuel une image moléculaire différente de la menace.
Le polymorphisme du processus de présentation de l’antigène est l’une des principales raisons (mais pas la seule – voir ci-dessous) pour lesquelles une exposition au même antigène peut produire une grande variété de réponses individuelles [38].
La génération stochastique des récepteurs des cellules T et des spécificités des anticorps
Les réponses immunitaires adaptatives sont déclenchées par la reconnaissance d’un peptide présenté par un récepteur spécifique (récepteur des cellules T, ou TCR) exprimé à la surface des cellules T CD4+ ou CD8+. Le site de liaison à l’antigène du TCR est généré par la recombinaison aléatoire de différents segments génétiques (sélectionnés à partir d’un catalogue de gènes aux loci V, J et D), l’ajout de nucléotides aléatoires à leurs sites d’épissage et des mutations somatiques (revues dans [39]). Un processus de génération aléatoire similaire (bien qu’à un locus génomique différent) est utilisé pour générer les anticorps exprimés et sécrétés par les cellules B lors de leur activation par les cellules T CD4+ (revue dans [40]).
En conséquence, et compte tenu du nombre quasi infini de TCR différents pouvant être générés par ce processus combinatoire, on ne peut s’attendre à ce que deux individus différents (y compris des jumeaux identiques) produisent des lymphocytes T (ou des anticorps) réactifs identiques contre un antigène donné, même s’ils se lieraient au même peptide présenté (pour les lymphocytes T) ou au même épitope (pour les lymphocytes B).
Outre le processus de présentation polymorphe de l’antigène, c’est la deuxième raison principale pour laquelle une exposition au même antigène produira à nouveau une grande variété de réponses individuelles. Ces réponses peuvent différer tant en intensité [41,42] qu’en épitope ciblé [43].
Le danger imminent de l’auto-immunité
Sans nous attarder sur les processus moléculaires détaillés qui régissent la synthèse des TCR ou des anticorps, qui sont pour la plupart bien élucidés, nous ne retiendrons qu’un seul concept central pour la suite de notre discussion : l’affinité des TCR ou des anticorps pour un antigène donné est fortuite et ne résulte d’aucune interaction préalable avec celui-ci. Cette affinité ne se manifeste qu’a posteriori, parmi toutes les cellules T naïves qui n’ont pas été éliminées à la suite de leur confrontation avec l’auto-immunopeptidome.
Comme l’affinité initiale d’un TCR pour un antigène n’est pas le résultat d’un processus de sélection, il n’y a aucune raison pour que leur interaction soit particulièrement forte ou spécifique. Cela a été confirmé expérimentalement. Par exemple, il a été démontré qu’un seul complexe peptide-CMH de classe II sélectionne positivement au moins 105 TCR différents (définis par différents réarrangements du gène variable Vβ) [44]. Parmi ces TCR, beaucoup présenteront également une affinité fonctionnelle (c’est-à-dire qu’ils déclencheront l’activation du lymphocyte T correspondant) pour un large spectre de peptides non apparentés [45]. Expérimentalement, il a été démontré qu’un seul TCR reconnaît plus d’un million de peptides [46]. Cela était prévisible, étant donné que l’univers des antigènes potentiels est d’un ordre de grandeur supérieur au nombre de TCR uniques chez un individu, ce qui nécessite un répertoire de TCR hautement réactif [47,48].
Par conséquent, la prolifération de chaque clone de lymphocytes T déclenchée par une réponse immunitaire naturelle ou induite par un vaccin comporte intrinsèquement le risque de déclencher une auto-immunité, dont la cible est à la fois imprévisible et potentiellement strictement individuelle. L’auto-immunité se manifestera alors par une grande variété de processus néfastes. Les auto-anticorps (promus par les lymphocytes T auxiliaires CD4+ autoréactifs) [49] peuvent se lier et inhiber des fonctions enzymatiques clés, interférer avec la signalisation hormonale en se liant à des ligands ou à des récepteurs, ou interférer avec l’activation de différents types de cellules en se liant à des protéines de surface. Les lymphocytes T CD8+ cytotoxiques autoréactifs commenceront à tuer des types de cellules spécifiques, altérant leurs fonctions biochimiques, régulatrices ou structurelles normales dans divers tissus ou organes [par exemple, [50]].
Cependant, et contrairement aux effets secondaires indésirables induits par les médicaments, qui ont tendance à être reproductibles chez les individus partageant des caractéristiques métaboliques (et/ou un patrimoine génétique) similaires, les effets indésirables induits par le système immunitaire devraient être extrêmement diversifiés, voire uniques (« privés ») à chaque individu en raison des multiples processus stochastiques qui régissent la réponse immunitaire décrite ci-dessus. Cela soulève la possibilité inquiétante que la forte immunisation déclenchée par les vaccinations ne soit pas aussi inoffensive qu’elle a été présentée pendant des années, au point de devenir l’un des paradigmes médicaux les plus incontestables.
Notre hypothèse : toutes les vaccinations pourraient être à l’origine d’une multitude d’effets indésirables spécifiques aux patients et non reconnus.
L’excellente réputation des vaccins découle de leur efficacité contre les différentes maladies infectieuses ciblées et de la rareté des effets indésirables récurrents (c’est-à-dire présentant des manifestations identiques chez différentes personnes). Cependant, nous émettons l’hypothèse que la rareté de ces effets indésirables « publics » (prévisibles compte tenu de la nature stochastique de la réponse immunitaire) pourrait masquer une fréquence (cumulative) beaucoup plus élevée d’accidents « privés » liés aux vaccins, qui restent statistiquement indétectables en raison de leur caractère non reproductible au sein de la population vaccinée.
En l’absence d’un signal statistique significatif, ces affections privées, même lorsqu’elles sont dûment signalées aux systèmes de notification des effets indésirables des vaccins (VAERS), finissent par être interprétées comme de simples coïncidences sans autre lien avec le processus de vaccination que leur lien de temporalité.
La plupart de ces rapports finiront par être publiés sur les réseaux sociaux [11,12] par les patients eux-mêmes, sans aucun moyen d’en évaluer la véracité. D’autres seront publiés sous forme de rapports de cas isolés dans des revues scientifiques de faible qualité (par exemple, [13,14,15,16,17]), et dans le pire des cas, seront qualifiés de « fausses nouvelles » délibérément propagées par des théoriciens du complot « anti-vaccins ».
Compte tenu de l’extrême diversité des symptômes post-vaccinaux signalés, allant de simples démangeaisons et maux de tête à des réactions allergiques graves, des manifestations neurologiques, des troubles cardiovasculaires, voire le déclenchement de divers cancers ou maladies auto-immunes, il est difficile pour la profession médicale actuelle, compartimentée en différentes spécialités, d’assumer et de rechercher une étiologie commune, au risque de saper le pilier que représente désormais la vaccination dans la politique de santé publique.
De plus, malgré ses progrès considérables au cours des 40 dernières années, on pourrait affirmer que l’immunologie n’a jusqu’à présent pas beaucoup contribué au développement des vaccins, dans la mesure où la plupart des vaccins que nous utilisons aujourd’hui ont été développés et testés de manière empirique [26]. Le principe de la vaccination et son utilisation généralisée sont largement antérieurs à notre compréhension détaillée des processus régissant les différents types de réponses immunitaires et leur régulation complexe par de multiples interleukines (revue dans [51]). Une mise à jour de nos connaissances aurait pu inciter à réévaluer les risques associés à la vaccination, mais cela ne s’est pas encore produit. La vaccination est un phénomène complexe impliquant l’interaction de nombreux types de cellules dans des compartiments distincts, le tout dans un contexte systémique façonné par l’histoire des stimuli immunitaires d’un individu. Un système biologique aussi complexe devrait présenter deux propriétés : 1) il ne peut fonctionner sans générer de manière aléatoire certaines erreurs [52], et 2) son fonctionnement entraîne différents états physiologiques qui reflètent le spectre des variations physiologiques et génétiques individuelles au sein des populations [53]. Ce dernier point met en évidence le paradoxe de la vaccination des populations selon des protocoles uniformes plutôt que de faire de la vaccination un archétype de la médecine personnalisée. Heureusement, la « vaccinomics » est désormais apparue comme un nouveau domaine de recherche dédié à la compréhension de l’hétérogénéité de la réponse immunitaire aux vaccins [54].
Ce que nous savons aujourd’hui sur le fonctionnement du système immunitaire laisse présager que les effets indésirables récurrents (c’est-à-dire publics) devraient être rares. Ils pourraient, par exemple, concerner des individus partageant des mutations de divers composants du système immunitaire [55,56], partageant des allèles HLA nuisibles (par exemple, [57,58,59]), et/ou exprimant des TCR auto-réactifs publics rares [60,61,62]. Ces caractéristiques peuvent se recouper avec celles qui augmentent la gravité des maladies infectieuses courantes [23,63,64,65].
En revanche, les effets indésirables privés pourraient provenir de chaque combinaison unique de légères variations du génome/protéome, d’haplotypes HLA rares (et de l’immunopeptidome correspondant) et de la sélection/expression stochastique de TCR totalement privés, dont l’un pourrait accidentellement conduire à l’auto-immunité. De nombreuses études ont également montré que la réponse immunitaire est sujette à des erreurs, l’auto-immunité étant fréquemment observée à la suite d’une (hyper) immunisation répétitive causée par la multiplication des injections de rappel [49,66,67].
Après avoir négligé pendant des années la recherche sur les mécanismes à l’origine des effets indésirables des vaccins, une nouvelle génération d’immunologistes semble enfin s’y intéresser [23].
Malheureusement, seuls les effets indésirables statistiquement prouvés, c’est-à-dire les plus fréquents et récurrents, seront ciblés par ces études de vaccinomics.
D’autre part, l’étude d’événements indésirables uniques isolés dans des populations vaccinées pose un problème méthodologique fondamental, car des observations répétées similaires d’un phénomène donné sont à la base même de l’approche scientifique. Sans la possibilité d’analyser plusieurs occurrences indépendantes des mêmes événements indésirables, il semble impossible de distinguer une simple coïncidence d’un lien de causalité avec la vaccination. Bien que dérivée de propriétés bien établies du système immunitaire, notre hypothèse pourrait donc être considérée comme infalsifiable et donc non scientifique. Cependant, symétriquement, la sécurité de la vaccination devient alors tout aussi indécidable.
Cependant, même en l’absence de répétitions, l’analyse d’une série d’événements indésirables strictement individuels pourrait donner lieu à des indices concordants, sans pour autant fournir une preuve formelle. Par exemple, les patients chez lesquels on soupçonne des complications post-vaccinales pourraient être systématiquement testés pour détecter la présence d’anticorps antinucléaires, considérés comme un signe récurrent d’auto-immunité contre un large éventail d’auto-antigènes. Des méthodologies de dépistage à l’échelle du protéome pourraient alors être utilisées pour identifier de nouveaux auto-anticorps contre des auto-antigènes non reconnus [68]. Malheureusement, l’identification à grande échelle de l’autoantigène ciblé par les lymphocytes T CD4+ ou CD8+ autoréactifs reste difficile [69].
La confiance passée dans la sécurité des vaccins a fait qu’aucun changement significatif n’a été apporté à la structure des essais cliniques pour les nouveaux vaccins. Tout d’abord, un antigène vaccinal est conçu pour déclencher une forte production d’anticorps neutralisants, avec peu ou pas d’analyse de la réponse cellulaire concomitante. La vaccination est ensuite testée (phase III) sur une cohorte relativement importante (≈ 30 000 personnes) afin d’évaluer son efficacité globale dans la prévention de la maladie correspondante et d’estimer la fréquence des effets indésirables graves (récurrents).
Aucune mesure n’est effectuée concernant la variabilité des réponses immunitaires individuelles et leurs liens éventuels avec les caractéristiques génotypiques des patients (ou même leurs haplotypes HLA). De plus, la période consacrée à la surveillance des effets indésirables éventuels (par exemple, parfois inférieure à 6 mois [9,70]) n’est pas compatible avec la période d’incubation généralement longue des maladies auto-immunes, et n’est donc pas adaptée pour invalider notre hypothèse.
Il existe déjà de sérieuses critiques concernant l’insuffisance des essais cliniques sur les vaccins [70,71], dont certaines ont été réactivées par la précipitation des vaccins contre le SARS-CoV2 [8,73]. Cependant, ces critiques visent des faiblesses méthodologiques spécifiques sans remettre globalement en cause la réputation irréprochable d’efficacité et de sécurité acquise par la vaccination depuis le siècle dernier.
Néanmoins, l’histoire de la médecine regorge d’exemples d’approches thérapeutiques qui étaient autrefois universellement louées, mais qui sont aujourd’hui abandonnées, voire considérées comme dangereuses (par exemple, les médicaments en vente libre tels que la codéine et l’aspirine, l’appendicectomie prophylactique, les amygdalectomies prophylactiques, les médicaments à base d’arsenic pour traiter la syphilis, etc.).
Dans cet article, nous suggérons que les connaissances détaillées dont nous disposons aujourd’hui sur le système immunitaire devraient nous amener à réévaluer rigoureusement le rapport bénéfice/risque de la vaccination, actuellement considéré comme incontestable. En attendant cette réévaluation, promouvoir une utilisation plus personnalisée des vaccins en développant la vaccinomique [74] et limiter leur utilisation aux maladies les plus graves (mortelles) semble être l’attitude la plus rationnelle.
References
- Montero, D.A.; Vidal, R.M.; Velasco, J.; Carreño, L.J.; Torres, J.P.; Benachi, O.M.A.; Tovar-Rosero, Y.Y.; Oñate, A.A.; O’Ryan, M. Two centuries of vaccination: historical and conceptual approach and future perspectives.Front Public Health. 2024, 11, 1326154. [Google Scholar] [CrossRef] [PubMed]
- Centers for Disease Control and Prevention (CDC). Control of infectious diseases.MMWR Morb Mortal Wkly Rep. 1999, 48, 621– [PubMed]
- Clark, S.E.; Bledsoe, M.C.; Harrison, C.J. The role of social media in promoting vaccine hesitancy.Curr Opin Pediatr. 2022, 34, 156– [Google Scholar] [CrossRef] [PubMed]
- Pertwee, E.; Simas, C.; Larson, H.J. An epidemic of uncertainty: rumors, conspiracy theories and vaccine hesitancy.Nat Med. 2022, 28, 456– [Google Scholar] [CrossRef] [PubMed]
- Heyerdahl, L.W.; Dielen, S.; Nguyen, T.; Van Riet, C.; Kattumana, T.; Simas, C.; Vandaele, N.; Vandamme, A.M.; Vandermeulen, C.; Giles-Vernick, T.; Larson, H.; Grietens, K.P.; Gryseels, C. Doubt at the core: Unspoken vaccine hesitancy among healthcare workers.Lancet Reg Health Eur. 2022, 12, 100289. [Google Scholar] [CrossRef] [PubMed]
- Biswas, N.; Mustapha, T.; Khubchandani, J.; Price, J.H. The Nature and Extent of COVID-19 Vaccination Hesitancy in Healthcare Workers.J Community Health. 2021, 46, 1244– [Google Scholar] [CrossRef] [PubMed]
- Bardosh, K.; de Figueiredo, A.; Gur-Arie, R.; Jamrozik, E.; Doidge, J.; Lemmens, T.; Keshavjee, S.; Graham, J.E.; Baral, S. The unintended consequences of COVID-19 vaccine policy: why mandates, passports and restrictions may cause more harm than good.BMJ Glob Health. 2022, 7, e008684. [Google Scholar] [CrossRef] [PubMed] [PubMed Central]
- Doshi, P. Will covid-19 vaccines save lives? Current trials aren’t designed to tell us. 2020, 371, m4037. [Google Scholar] [CrossRef] [PubMed]
- Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, Perez JL, Pérez Marc G, Moreira ED, Zerbini C, Bailey R, Swanson KA, Roychoudhury S, Koury K, Li P, Kalina WV, Cooper D, Frenck RW Jr, Hammitt LL, Türeci Ö, Nell H, Schaefer A, Ünal S, Tresnan DB, Mather S, Dormitzer PR, Şahin U, Jansen KU, Gruber WC; C4591001 Clinical Trial Group. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine.N Engl J Med. 2020, 383, 2603–2615. [CrossRef] [PubMed]
- Thacker, P.D. Covid-19: Researcher blows the whistle on data integrity issues in Pfizer’s vaccine trial. 2021, 375, n2635. [Google Scholar] [CrossRef] [PubMed]
- Khullar, D. Social Media and Medical Misinformation: Confronting New Variants of an Old Problem. 2022, 328, 1393–1394. [Google Scholar] [CrossRef] [PubMed]
- Allen, M.R.; Desai, N.; Namazi, A.; Leas, E.; Dredze, M.; Smith, D.M.; Ayers, J.W. Characteristics of X (Formerly Twitter) Community Notes Addressing COVID-19 Vaccine Misinformation. 2024, 331, 1670–1672. [Google Scholar] [CrossRef] [PubMed]
- Yoshino, Y.; Yamanaka, Y.; Oda, A. Otitis Media with ANCA-Associated Vasculitis Following COVID-19 mRNA Vaccination: A Case Report.Am J Case Rep. 2024, 25, e945301. [Google Scholar] [CrossRef] [PubMed]
- Ueda, M.; Uchimura, K.; Ohkoshi, K.; Saegusa, N.; Osano, K.; Yoshida, S.; Konishi, M.; Ishii, T.; Takahashi, K.; Nakashima, A. A Severe Case of Rhabdomyolysis Requiring Renal Replacement Therapy Following COVID-19 mRNA Vaccination.Intern Med. 2025, 64, 1547– [Google Scholar] [CrossRef] [PubMed]
- Beckerman, J.K.; Yaghi, O.; Nassereddine, S. Acquired haemophilia A following COVID-19 vaccine.BMJ Case Rep. 2025, 18, e263299. [Google Scholar] [CrossRef] [PubMed]
- Xu, X.; Ding, W.; Song, H.; Wang, D. Unique skin nodules following COVID-19 vaccination: a case report of cutaneous plasmacytosis and review of the literature.Virol J. 2025, 22, 57. [Google Scholar] [CrossRef] [PubMed]
- Dalfardi, B.; Rad, N.K.; Mohammad Alizade, T.; Edalatifard, M.; Asadi, S.; Rahimi, B. Unexpected hypereosinophilia after Sinopharm vaccination: a case report.BMC Infect Dis. 2025, 25, 583. [Google Scholar] [CrossRef] [PubMed]
- Lamprinou, M.; Sachinidis, A.; Stamoula, E.; Vavilis, T.; Papazisis, G. COVID-19 vaccines adverse events: potential molecular mechanisms.Immunol Res. 2023, 71, 356– [Google Scholar] [CrossRef] [PubMed]
- Yasmin, F.; Najeeb, H.; Naeem, U.; Moeed, A.; Atif, A.R.; Asghar, M.S.; Nimri, N.; Saleem, M.; Bandyopadhyay, D.; Krittanawong, C.; Fadelallah Eljack, M.M.; Tahir, M.J.; Waqar, F. Adverse events following COVID-19 mRNA vaccines: A systematic review of cardiovascular complication, thrombosis, and thrombocytopenia.Immun Inflamm Dis. 2023, 11, e807. [Google Scholar] [CrossRef] [PubMed]
- Ota, N.; Itani, M.; Aoki, T.; Sakurai, A.; Fujisawa, T.; Okada, Y.; Noda, K.; Arakawa, Y.; Tokuda, S.; Tanikawa, R. Expression of SARS-CoV-2 spike protein in cerebral Arteries: Implications for hemorrhagic stroke Post-mRNA vaccination.J Clin Neurosci. 2025, 136, 111223. [Google Scholar] [CrossRef] [PubMed]
- Bar-Joseph, H.; Raz, Y.; Eldar-Boock, A.; Michaan, N.; Angel, Y.; Saiag, E.; Nemerovsky, L.; Ben-Ami, I.; Shalgi, R.; Grisaru, D. The direct effect of SARS-CoV-2 virus vaccination on human ovarian granulosa cells explains menstrual irregularities.NPJ Vaccines. 2024, 9, 117. [Google Scholar] [CrossRef] [PubMed]
- Faksova, K.; Walsh, D.; Jiang, Y.; Griffin, J.; Phillips, A.; Gentile, A.; Kwong, J.C.; Macartney, K.; Naus, M.; Grange, Z.; Escolano, S.; Sepulveda, G.; Shetty, A.; Pillsbury, A.; Sullivan, C.; Naveed, Z.; Janjua, N.Z.; Giglio, N.; Perälä, J.; Nasreen, S.; Gidding, H.; Hovi, P.; Vo, T.; Cui, F.; Deng, L.; Cullen, L.; Artama, M.; Lu, H.; Clothier, H.J.; Batty, K.; Paynter, J.; Petousis-Harris, H.; Buttery, J.; Black, S.; Hviid, A. COVID-19 vaccines and adverse events of special interest: A multinational Global Vaccine Data Network (GVDN) cohort study of 99 million vaccinated individuals. 2024, 42, 2200–2211. [Google Scholar] [CrossRef] [PubMed]
- Bolze A, Mogensen TH, Zhang SY, Abel L, Andreakos E, Arkin LM, Borghesi A, Brodin P, Hagin D, Novelli G, Okada S, Peter J, Renia L, Severe K, Tiberghien P, Vinh DC; COVID human genetic effort; Cirulli ET, Casanova JL, Hsieh EWY. Decoding the Human Genetic and Immunological Basis of COVID-19 mRNA Vaccine-Induced Myocarditis. J Clin Immunol. 2022 Oct;42(7):1354-1359. [CrossRef] [PubMed]
- Dudley, M.Z.; Gerber, J.E.; Budigan Ni, H.; Blunt, M.; Holroyd, T.A.; Carleton, B.C.; Poland, G.A.; Salmon, D.A. Vaccinomics: A scoping review. 2023, 41, 2357–2367. [Google Scholar] [CrossRef] [PubMed] [PubMed Central]
- Chaudhary, N.; Weissman, D.; Whitehead, K.A. mRNA vaccines for infectious diseases: principles, delivery and clinical translation.Nat Rev Drug Discov. 2021, 20, 817– [Google Scholar] [CrossRef] [PubMed]
- Not immunePollard, A.J.; Bijker, E.M. A guide to vaccinology: from basic principles to new developments.Nat Rev Immunol. 2021, 21, 83– [Google Scholar] [CrossRef] [PubMed]
- Li, Y.; Chen, N.; Guo, Y.; Zhang, L. The stress and the alarmin-like cytokine interleukin-37 mediated extracellular and intracellular signal pathways.Semin Immunol. 2025, 78, 101952. [Google Scholar] [CrossRef] [PubMed]
- Trolle, T.; McMurtrey, C.P.; Sidney, J.; Bardet, W.; Osborn, S.C.; Kaever, T.; Sette, A.; Hildebrand, W.H.; Nielsen, M.; Peters, B. The Length Distribution of Class I-Restricted T Cell Epitopes Is Determined by Both Peptide Supply and MHC Allele-Specific Binding Preference.J Immunol. 2016, 196, 1480– [Google Scholar] [CrossRef] [PubMed]
- MacLachlan, B.J.; Dolton, G.; Papakyriakou, A.; Greenshields-Watson, A.; Mason, G.H.; Schauenburg, A.; Besneux, M.; Szomolay, B.; Elliott, T.; Sewell, A.K.; Gallimore, A.; Rizkallah, P.; Cole, D.K.; Godkin, A. Human leukocyte antigen (HLA) class II peptide flanking residues tune the immunogenicity of a human tumor-derived epitope.J Biol Chem. 2019, 294, 20246– [Google Scholar] [CrossRef] [PubMed]
- Balakrishnan, A.; Winiarek, G.; Hołówka, O.; Godlewski, J.; Bronisz, A. Unlocking the secrets of the immunopeptidome: MHC molecules, ncRNA peptides, and vesicles in immune response.Front Immunol. 2025, 16, 1540431. [Google Scholar] [CrossRef] [PubMed]
- Abelin, J.G.; Keskin, D.B.; Sarkizova, S.; Hartigan, C.R.; Zhang, W.; Sidney, J.; Stevens, J.; Lane, W.; Zhang, G.L.; Eisenhaure, T.M.; Clauser, K.R.; Hacohen, N.; Rooney, M.S.; Carr, S.A.; Wu, C.J. Mass Spectrometry Profiling of HLA-Associated Peptidomes in Mono-allelic Cells Enables More Accurate Epitope Prediction. 2017, 46, 315–326. [Google Scholar] [CrossRef] [PubMed]
- Xing, Y.; Hogquist, K.A. T-cell tolerance: central and peripheral.Cold Spring Harb Perspect Biol. 2012, 4, a006957. [Google Scholar] [CrossRef] [PubMed]
- Amaral, P.; Carbonell-Sala, S.; De La Vega, F.M.; Faial, T.; Frankish, A.; Gingeras, T.; Guigo, R.; Harrow, J.L.; Hatzigeorgiou, A.G.; Johnson, R.; Murphy, T.D.; Pertea, M.; Pruitt, K.D.; Pujar, S.; Takahashi, H.; Ulitsky, I.; Varabyou, A.; Wells, C.A.; Yandell, M.; Carninci, P.; Salzberg, S.L. The status of the human gene catalogue. 2023, 622, 41–47. [Google Scholar] [CrossRef] [PubMed]
- Joyce, S.; Ternette, N. Know thy immune self and non-self: Proteomics informs on the expanse of self and non-self, and how and where they arise. Proteomics. 2021, 21(23-24):e2000143. [CrossRef] [PubMed]
- Bassani-Sternberg, M.; Pletscher-Frankild, S.; Jensen, L.J.; Mann, M. Mass spectrometry of human leukocyte antigen class I peptidomes reveals strong effects of protein abundance and turnover on antigen presentation.Mol Cell Proteomics. 2015, 14, 658– [Google Scholar] [CrossRef] [PubMed]
- Kourilsky, P.; Chaouat, G.; Rabourdin-Combe, C.; Claverie, J.M. Working principles in the immune system implied by the “peptidic self” model. Proc Natl Acad Sci U S A.1987, 84, 3400– [Google Scholar] [CrossRef] [PubMed]
- 1000 Genomes Project Consortium; Auton A, Brooks LD, Durbin RM, Garrison EP, Kang HM, Korbel JO, Marchini JL, McCarthy S, McVean GA, Abecasis GR. A global reference for human genetic variation. Nature. 2015 Oct 1;526(7571):68-74. [CrossRef] [PubMed]
- Xie, J.; Mothe, B.; Alcalde Herraiz, M.; Li, C.; Xu, Y.; Jödicke, A.M.; Gao, Y.; Wang, Y.; Feng, S.; Wei, J.; Chen, Z.; Hong, S.; Wu, Y.; Su, B.; Zheng, X.; Cohet, C.; Ali, R.; Wareham, N.; Alhambra, D.P. Relationship between HLA genetic variations, COVID-19 vaccine antibody response, and risk of breakthrough outcomes.Nat Commun. 2024, 15, 4031. [Google Scholar] [CrossRef] [PubMed]
- Weng, N.P. Numbers and odds: TCR repertoire size and its age changes impacting on T cell functions.Semin Immunol. 2023, 69, 101810. [Google Scholar] [CrossRef] [PubMed]
- Zhang, Y.; Zhang, X.; Dai, H.Q.; Hu, H.; Alt, F.W. The role of chromatin loop extrusion in antibody diversification.Nat Rev Immunol. 2022, 22, 550– [Google Scholar] [CrossRef] [PubMed]
- van der Heiden, M.; Shetty, S.; Bijvank, E.; Beckers, L.; Cevirgel, A.; van Sleen, Y.; Tcherniaeva, I.; Ollinger, T.; Burny, W.; van Binnendijk, R.S.; van Houten, M.A.; Buisman, A.M.; Rots, N.Y.; van Beek, J.; van, B. Multiple vaccine comparison in the same adults reveals vaccine-specific and age-related humoral response patterns: an open phase IV trial.Nat Commun. 2024, 15, 6603. [Google Scholar] [CrossRef] [PubMed]
- Karp-Tatham, E.; Knight, J.C.; Bolze, A. Human genetics of responses to vaccines.Clin Exp Immunol. 2025 May 21, uxaf034. [CrossRef] [PubMed]
- Wu, D.; Kolesnikov, A.; Yin, R.; Guest, J.D.; Gowthaman, R.; Shmelev, A.; Serdyuk, Y.; Dianov, D.V.; Efimov, G.A.; Pierce, B.G.; Mariuzza, R.A. Structural assessment of HLA-A2-restricted SARS-CoV-2 spike epitopes recognized by public and private T-cell receptors.Nat Commun. 2022, 13, 19. [Google Scholar] [CrossRef] [PubMed]
- Gapin, L.; Fukui, Y.; Kanellopoulos, J.; Sano, T.; Casrouge, A.; Malier, V.; Beaudoing, E.; Gautheret, D.; Claverie, J.M.; Sasazuki, T.; Kourilsky, P. Quantitative analysis of the T cell repertoire selected by a single peptide-major histocompatibility complex.J Exp Med. 1998, 187, 1871– [Google Scholar] [CrossRef] [PubMed]
- Ignatowicz, L.; Rees, W.; Pacholczyk, R.; Ignatowicz, H.; Kushnir, E.; Kappler, J.; Marrack, P. T cells can be activated by peptides that are unrelated in sequence to their selecting peptide. 1997, 7, 179–186. [Google Scholar] [CrossRef] [PubMed]
- Wooldridge, L.; Ekeruche-Makinde, J.; van den Berg, H.A.; Skowera, A.; Miles, J.J.; Tan, M.P.; Dolton, G.; Clement, M.; Llewellyn-Lacey, S.; Price, D.A.; Peakman, M.; Sewell, A.K. A single autoimmune T cell receptor recognizes more than a million different peptides.J Biol Chem. 2012, 287, 1168– [Google Scholar] [CrossRef] [PubMed]
- Mason, D. A very high level of crossreactivity is an essential feature of the T-cell receptor.Immunol Today. 1998, 19, 395– [Google Scholar] [CrossRef] [PubMed]
- Sewell, A.K. Why must T cells be cross-reactive?Nat Rev Immunol. 2012, 12, 669– [Google Scholar] [CrossRef] [PubMed]
- Sacchi, M.C.; Pelazza, C.; Bertolotti, M.; Agatea, L.; De Gaspari, P.; Tamiazzo, S.; Ielo, D.; Stobbione, P.; Grappiolo, M.; Bolgeo, T.; Novel, P.; Ciriello, M.M.; Maconi, A. The onset ofde novo autoantibodies in healthcare workers after mRNA based anti-SARS-CoV-2 vaccines: a single centre prospective follow-up study. 2023, 56, 2229072. [Google Scholar] [CrossRef] [PubMed]
- Ayoub, I.; Freeman, S.A.; Saoudi, A.; Liblau, R. Infection, vaccination and narcolepsy type 1: Evidence and potential molecular mechanisms.J Neuroimmunol. 2024, 393, 578383. [Google Scholar] [CrossRef] [PubMed]
- Dong, C. Cytokine Regulation and Function in T Cells.Annu Rev Immunol. 2021, 39, 51– [Google Scholar] [CrossRef] [PubMed]
- Siegel, R.M.; Katsumata, M.; Komori, S.; Wadsworth, S.; Gill-Morse, L.; Jerrold-Jones, S.; Bhandoola, A.; Greene, M.I.; Yui, K. Mechanisms of autoimmunity in the context of T-cell tolerance: insights from natural and transgenic animal model systems.Immunol Rev. 1990, 118, 165– [Google Scholar] [CrossRef] [PubMed]
- Dudley, M.Z.; Gerber, J.E.; Budigan Ni, H.; Blunt, M.; Holroyd, T.A.; Carleton, B.C.; Poland, G.A.; Salmon, D.A. Vaccinomics: A scoping review. 2023, 41, 2357–2367. [Google Scholar] [CrossRef] [PubMed]
- Poland, G.A.; Ovsyannikova, I.G.; Jacobson, R.M.; Smith, D.I. Heterogeneity in vaccine immune response: the role of immunogenetics and the emerging field of vaccinomics.Clin Pharmacol Ther. 2007, 82, 653– [Google Scholar] [CrossRef] [PubMed]
- Hill, A.V. The immunogenetics of human infectious diseases.Annu Rev Immunol. 1998, 16, 593– [Google Scholar] [CrossRef] [PubMed]
- Peng, X.P.; Caballero-Oteyza, A.; Grimbacher, B. Common Variable Immunodeficiency: More Pathways than Roads to Rome.Annu Rev Pathol. 2023, 18, 283– [Google Scholar] [CrossRef] [PubMed]
- Ayoub, I.; Freeman, S.A.; Saoudi, A.; Liblau, R. Infection, vaccination and narcolepsy type 1: Evidence and potential molecular mechanisms.J Neuroimmunol. 2024, 393, 578383. [Google Scholar] [CrossRef] [PubMed]
- Trowsdale, J.; Knight, J.C. Major histocompatibility complex genomics and human disease.Annu Rev Genomics Hum Genet. 2013, 14, 301– [Google Scholar] [CrossRef] [PubMed]
- Busch, R.; Kollnberger, S.; Mellins, E.D. HLA associations in inflammatory arthritis: emerging mechanisms and clinical implications.Nat Rev Rheumatol. 2019, 15, 364– [Google Scholar] [CrossRef] [PubMed]
- Ria, F.; van den Elzen, P.; Madakamutil, L.T.; Miller, J.E.; Maverakis, E.; Sercarz, E.E. Molecular characterization of the T cell repertoire using immunoscope analysis and its possible implementation in clinical practice.Curr Mol Med. 2001, 1, 297– [Google Scholar] [CrossRef] [PubMed]
- Yang, X.; Garner, L.I.; Zvyagin, I.V.; Paley, M.A.; Komech, E.A.; Jude, K.M.; Zhao, X.; Fernandes, R.A.; Hassman, L.M.; Paley, G.L.; Savvides, C.S.; Brackenridge, S.; Quastel, M.N.; Chudakov, D.M.; Bowness, P.; Yokoyama, W.M.; McMichael, A.J.; Gillespie, G.M.; Garcia, K.C. Autoimmunity-associated T cell receptors recognize HLA-B*27-bound peptides. 2022, 612, 771–777. [Google Scholar] [CrossRef] [PubMed]
- Yin, Y.; Li, Y.; Mariuzza, R.A. Structural basis for self-recognition by autoimmune T-cell receptors.Immunol Rev. 2012, 250, 32– [Google Scholar] [CrossRef] [PubMed]
- Le Voyer, T.; Maglorius Renkilaraj, M.R.L.; Moriya, K.; Pérez Lorenzo, M.; Nguyen, T.; Gao, L.; Rubin, T.; Cederholm, A.; Ogishi, M.; Arango-Franco, C.A.; Béziat, V.; Lévy, R.; Migaud, M.; Rapaport, F.; Itan, Y.; Deenick, E.K.; Cortese, I.; Lisco, A.; Boztug, K.; Abel, L.; Boisson-Dupuis, S.; Boisson, B.; Frosk, P.; Ma, C.S.; Landegren, N.; Celmeli, F.; Casanova, J.L.; Tangye, S.G.; Puel, A. Inherited human RelB deficiency impairs innate and adaptive immunity to infection.Proc Natl Acad Sci U S A. 2024, 121, e2321794121. [Google Scholar] [CrossRef] [PubMed] [PubMed Central]
- Cunningham-Rundles, C.; Casanova, J.L.; Boisson, B. Genetics and clinical phenotypes in common variable immunodeficiency.Front Genet. 2024, 14, 1272912. [Google Scholar] [CrossRef] [PubMed]
- Casanova, J.L.; Abel, L. From rare disorders of immunity to common determinants of infection: Following the mechanistic thread. 2022, 185, 3086–3103. [Google Scholar] [CrossRef] [PubMed]
- Świerkot, J.; Madej, M.; Szmyrka, M.; Korman, L.; Sokolik, R.; Andrasiak, I.; Morgiel, E.; Sebastian, A. The Risk of Autoimmunity Development following mRNA COVID-19 Vaccination. 2022, 14, 2655. [Google Scholar] [CrossRef] [PubMed]
- Ruiz, J.T.; Luján, L.; Blank, M.; Shoenfeld, Y. Adjuvants- and vaccines-induced autoimmunity: animal models.Immunol Res. 2017, 65, 55– [Google Scholar] [CrossRef] [PubMed]
- Vazquez, S.E.; Ferré, E.M.; Scheel, D.W.; Sunshine, S.; Miao, B.; Mandel-Brehm, C.; Quandt, Z.; Chan, A.Y.; Cheng, M.; German, M.; Lionakis, M.; DeRisi, J.L.; Anderson, M.S. Identification of novel, clinically correlated autoantigens in the monogenic autoimmune syndrome APS1 by proteome-wide PhIP-Seq. 2020, 9, e55053. [Google Scholar] [CrossRef] [PubMed]
- Rojas, M.; Acosta-Ampudia, Y.; Heuer, L.S.; Zang, W.; MMonsalve, D.; Ramírez-Santana, C.; Anaya, J.M.; MRidgway, W.; AAnsari, A.; Gershwin, M.E. Antigen-specific T cells and autoimmunity.J Autoimmun. 2024, 148, 103303. [Google Scholar] [CrossRef] [PubMed]
- Frenck RW Jr, Klein NP, Kitchin N, Gurtman A, Absalon J, Lockhart S, Perez JL, Walter EB, Senders S, Bailey R, Swanson KA, Ma H, Xu X, Koury K, Kalina WV, Cooper D, Jennings T, Brandon DM, Thomas SJ, Türeci Ö, Tresnan DB, Mather S, Dormitzer PR, Şahin U, Jansen KU, Gruber WC; C4591001 Clinical Trial Group. Safety, Immunogenicity, and Efficacy of the BNT162b2 Covid-19 Vaccine in Adolescents.N Engl J Med. 2021, 385, 239– [CrossRef] [PubMed]
- Salmon, D.A.; Orenstein, W.A.; Plotkin, S.A.; Chen, R.T. Funding Postauthorization Vaccine-Safety Science.N Engl J Med. 2024, 391, 102– [Google Scholar] [CrossRef] [PubMed]
- Dudley, M.Z.; Halsey, N.A.; Omer, S.B.; Orenstein, W.A.; O’Leary, S.T.; Limaye, R.J.; Salmon, D.A. The state of vaccine safety science: systematic reviews of the evidence.Lancet Infect Dis. 2020, 20, e80– [Google Scholar] [CrossRef] [PubMed]
- Wu, Q.; Dudley, M.Z.; Chen, X.; Bai, X.; Dong, K.; Zhuang, T.; Salmon, D.; Yu, H. Evaluation of the safety profile of COVID-19 vaccines: a rapid review.BMC Med. 2021, 19, 173. [Google Scholar] [CrossRef] [PubMed]
- Al-Eitan, L.N.; ElMotasem, M.F.M.; Khair, I.Y.; Alahmad, S.Z. Vaccinomics: Paving the Way for Personalized Immunization.Curr Pharm Des. 2024, 30, 1031– [Google Scholar] [CrossRef] [PubMed]
| Disclaimer/Publisher’s Note: The statements, opinions and data contained in all publications are solely those of the individual author(s) and contributor(s) and not of MDPI and/or the editor(s). MDPI and/or the editor(s) disclaim responsibility for any injury to people or property resulting from any ideas, methods, instructions or products referred to in the content. |
Copyright: This open access article is published under a Creative Commons CC BY 4.0 license, which permit the free download, distribution, and reuse, provided that the author and preprint are cited in any reuse.