Alerte sanitaire sur les Vaccins ARNm contre la Covid-19
(Comirnaty de Pfizer et Spikevax de Moderna)
Le collectif Les Enfants d’Hippocrate souhaite alerter les décideurs publics et les autorités de santé des problématiques sanitaires liées aux vaccins anti-covid.
Les documents publics, les documents confidentiels déclassifiés, ainsi que l’abondante littérature scientifique, démontrent des défauts majeurs de qualité, de sécurité et d’efficacité des produits dénommés vaccins anti-Covid à ARNm : Comirnaty et Spikevax.
Ces vaccins présentent un défaut de qualité intrinsèque :
Mis au point en un temps record, sur la base d’une technologie nouvelle et sans recul, mis sur le marché de manière conditionnelle à partir de données incomplètes, y compris concernant la qualité même du produit, de nombreux défauts de qualité sont désormais avérés.
Ces vaccins ne répondent pas aux exigences qualité réglementaires.
1- Une dissimulation de données aux autorités de santé (EMA, ANSM) par le laboratoire Pfizer
2- Une fabrication non maîtrisée ne respectant pas les bonnes pratiques de fabrication des médicaments
3- Des contrôles qualité inadaptés à ces nouvelles technologies
Ces vaccins présentent en conséquence des défauts de qualité inadmissibles aux retombées imprévisibles.
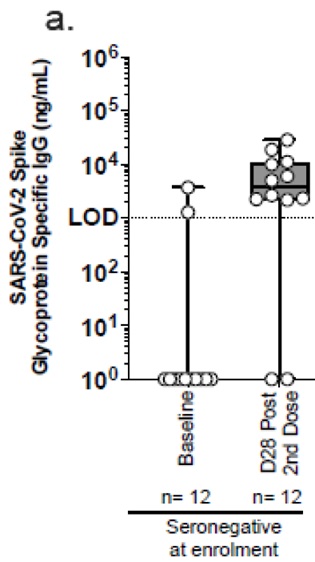
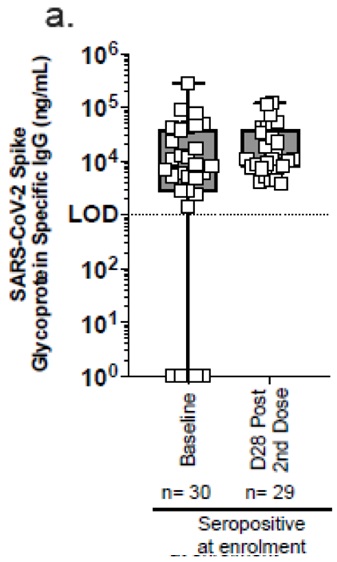
4- Jusqu’à 49 % d’ARNm incomplets codant une protéine Spike défectueuse
5- La modification de l’ARNm (remplacement des uridines par des pseudouridines) affecte la fidélité de traduction (passage de l’ARNm à la protéine) conduisant à des protéines Spike aberrantes et tronquées (Mulroney et al-Nature-2024)
6- Des taux résiduels d’ADN plasmidique au-delà des seuils réglementaires sur certains lots
7- La présence d’une séquence du virus SV40 oncogène
Des données habituellement requises pour une mise sur le marché standard sont encore manquantes à ce jour.
8- La dose réelle d’ARNm complets injectée est non maîtrisée et inconnue
9- La quantité de Spike produite par les vaccinés est non maîtrisée, non étudiée et inconnue
10- Les délais de persistance de l’ARNm et de Spike dans le corps humain sont inconnus
11- Les autorités de santé ne connaissent pas la biodistribution exacte tant de l’ARNm que de la protéine Spike qu’il code
Ces vaccins présentent des défauts majeurs de sécurité
Administrés à des personnes saines dans un but préventif, ces produits devraient par conséquent présenter une sécurité maximale.
Malheureusement les données scientifiques accumulées démontrent des défauts de sécurité majeurs pour ces produits, qui ont été pourtant administrés y compris aux enfants et aux femmes enceintes, sans études cliniques robustes susceptibles de le justifier.
12- L’ARNm et Spike envahissent tout l’organisme et s’accumulent dans certains organes
13- Spike est une protéine présentant une toxicité intrinsèque notamment proinflammatoire, prothrombogène, amyloïde.
14- Un passage transplacentaire avec atteinte fœtale est démontré chez l’animal
15- Un passage dans le lait maternel est démontré chez la femme allaitante
16- Aucune étude de génotoxicité ni de carcinogénicité alors qu’un risque est reconnu par le TGA (autorité Australienne)
Les données de pharmacovigilance accumulées depuis 2021 par l’EMA, l’ANSM ou le VAERS dans tous les pays du monde sont très inquiétantes.
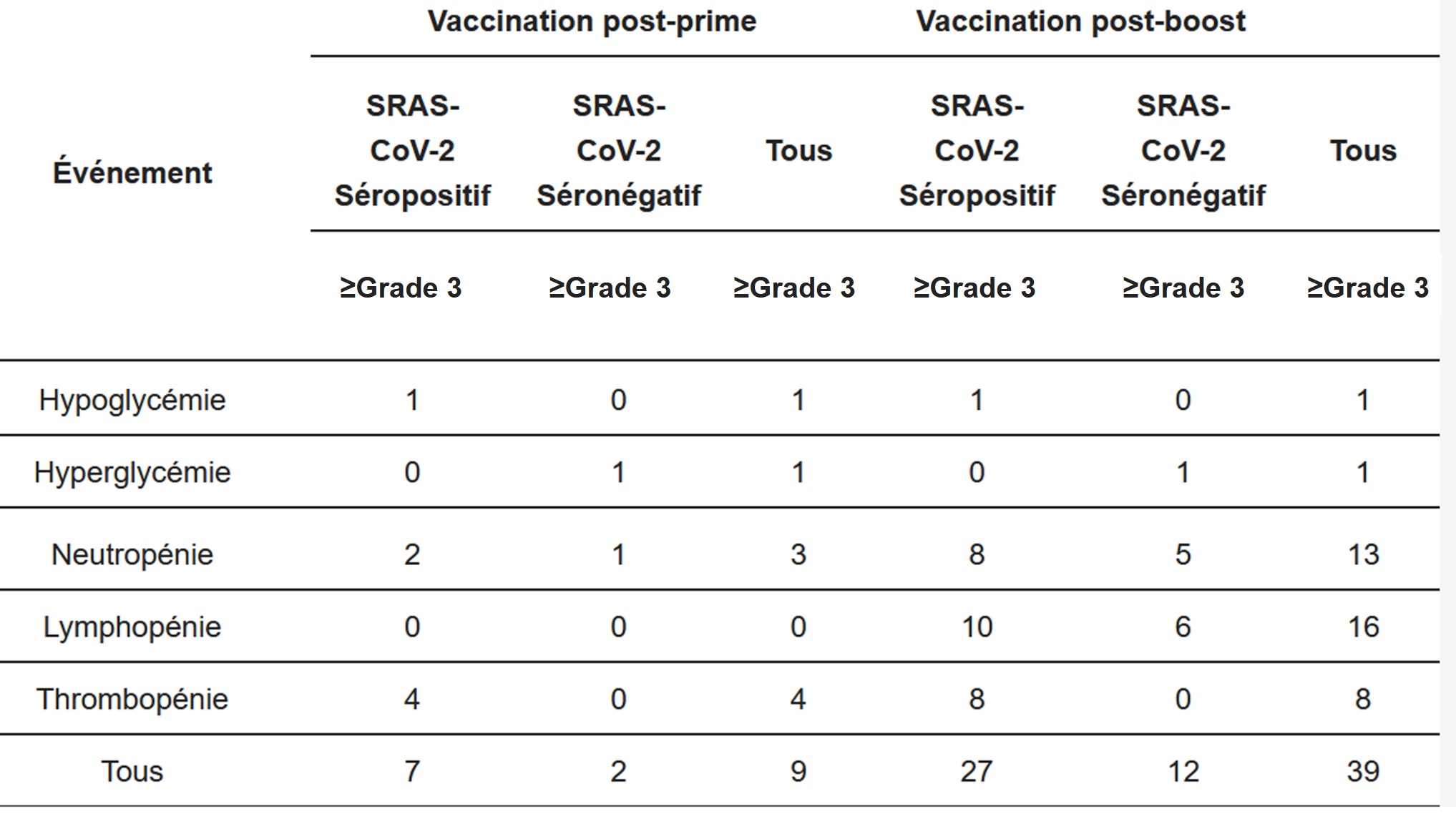
17- Un nombre historique d’effets secondaires: 2.9 personnes sur 1000 personnes ayant reçu au moins une dose présentent un effet indésirable
18- Un taux inadmissible d’effets indésirables graves: environ 1 personnes sur 1000 vaccinées a présenté un effet indésirable GRAVE en France (données ANSM au 24/02/2023)
19- La découverte au fil du temps d’effets indésirables inconnus jusqu’alors
20- Des effets à moyen et long terme toujours inconnus
Les victimes d’effets secondaires s’accumulent en silence depuis 2021 sans prise en charge médicale adaptée et reconnue.
Ces vaccins présentent des défauts majeurs d’efficacité
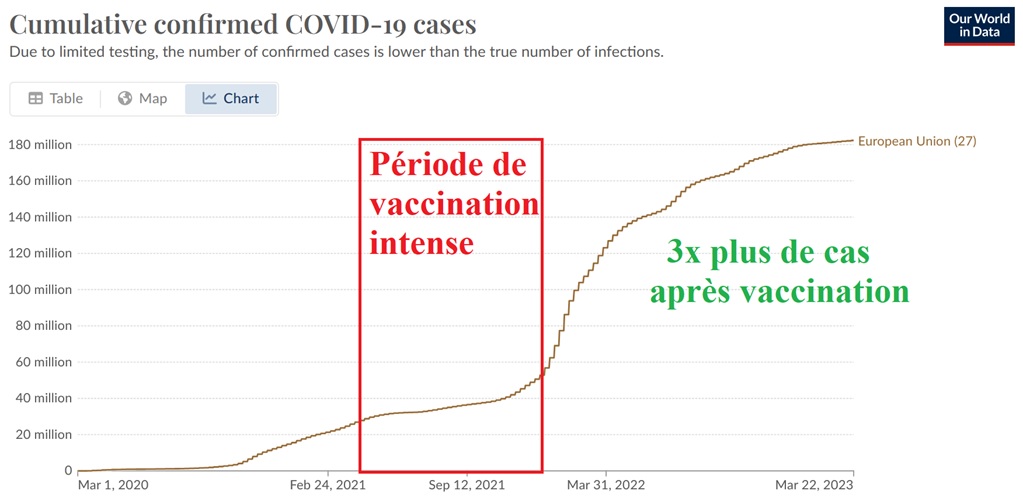
L’efficacité relative des vaccins de 95% présentée par les laboratoires n’a jamais été retrouvée en vie réelle et s’est rapidement avérée complètement fausse avec l’apparition de variants du SARS-CoV-2. L’efficacité revendiquée sur les formes graves n’a pas été démontrée formellement par les essais cliniques de phase 3. L’efficacité sur la transmission n’a jamais été prouvée contrairement à ce qu’affirme la propagande médiatique et institutionnelle du « Tous vaccinés, Tous protégés ».
L’efficacité des nouvelles adaptations du vaccin aux variants n’a jamais été démontrée cliniquement et reste donc inconnue.
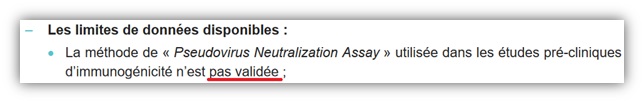
21- Efficacité surestimée dès le départ et inconnue chez les malades à risque
22- Aucun effet sur la transmission du virus SARS-CoV-2
23- Efficacité clinique des adaptations aux nouveaux variants non prouvée
Ces produits présentent donc une balance bénéfice – risque défavorable.
Au vu des défauts majeurs et inacceptables démontrés de ces vaccins, l’association Les Enfants d’Hippocrate, représentant scientifiques, médecins, usagers de santé et victimes d’effets indésirables, exige immédiatement au nom de la protection des citoyens et de la démocratie sanitaire:
- Le retrait immédiat du marché des produits à ARNm, chez l’humain et l’animal
- Un moratoire sur la recherche clinique sur les ARNm
- L’étude exhaustive et indépendante de ces produits
- La reconnaissance et la prise en charge financière, psychologique et médicale des victimes des injections antiCovid19 et des syndrômes post infectieux Covid
- L’information exhaustive aux soignants et au public sur cette thématique
- La mise en place de filières de recherche clinique et fondamentale, et de soins, susceptibles d’améliorer le diagnostic et les traitements des victimes d’effets indésirables des injections antiCovid et des victimes de Covid longs
- Le développement et l’accès au dosage diagnostic de la protéine Spike vaccinale et virale
Références
Une dissimulation de données aux autorités de santé (EMA, ANSM) par le laboratoire
https://fragdenstaat.de/anfrage/questions-regarding-the-rapporteurs-rolling-review-assessment-report-of-19-11-2020/
https://osf.io/preprints/osf/mjc97_v1
https://factreview.s3.eu-central-1.amazonaws.com/uploads/2023/07/Rolling-Review-Report-Quality-COVID-19-mRNA-Vaccine-BioNTech.pdf
Une fabrication non maîtrisée ne respectant pas les bonnes pratiques de fabrication des médicaments avec une variabilité inter lots et des procédés de fabrication différents non démontrés équivalents
https://prd-tsn-main-api.s3.amazonaws.com/article/13d1ad53-0c0d-4163-941f-81c50f00f8c6.pdf
https://pubmed.ncbi.nlm.nih.gov/38057663/ (Mulroney et al, 2024)
https://www.nejm.org/doi/suppl/10.1056/NEJMoa2034577/suppl_file/nejmoa2034577_protocol.pdf
https://factreview.s3.eu-central-1.amazonaws.com/uploads/2023/07/Rolling-Review-Report-Quality-COVID-19-mRNA-Vaccine-BioNTech.pdf)
https://www.bmj.com/content/378/bmj.o1731/rr-2
Des contrôles qualité inadaptés à ces nouvelles technologies:
Milne C, Wagner R, Cano F, Bruysters M, Waeterloos G, Pullirsch D, Wierer M, Mallet L. Independent control of COVID-19 vaccines by EU Official Control Authority Batch Release: challenges, strengths and successes. NPJ Vaccines. 2023 Feb 23;8(1):22. doi: 10.1038/s41541-023-00617-x. PMID: 36823287; PMCID:PMC9950138. https://www.ema.europa.eu/en/human-regulatory-overview/public-health-threats/coronavirus-disease-covid-19/covid-19-medicines/covid-19-vaccines-key-facts
Yang H. Establishing acceptable limits of residual DNA. PDA J Pharm Sci Technol. 2013 Mar-Apr;67(2):155-63. doi: 10.5731/pdajpst.2013.00910. PMID: 23569076.
https://www.edqm.eu/documents/52006/277490/Guideline+for+Pandemic+COVID-19+Vaccine+%28mRNA%29.doc/2c5dbe5c-1003-6949-eab9-5fc562062d88?t=1642426198777
L’ARNm et la spike envahissent tout l’organisme et s’accumulent dans certains organes selon la littérature scientifique :
https://www.ema.europa.eu/en/documents/other/ema-reply-follow-covi-exchange-views-27-march-2023_en.pdf
Japanese Pharmaceuticals and Medical Devices Agency (PMDA) SARS-CoV-2 mRNA Vaccine (BNT162, PF-07302048) 2021. [(accessed on 7 April 2023)]. Available online: https://www.pmda.go.jp/drugs/2021/P20210212001/672212000_30300AMX00231_I100_1.pdf.
Judicial Watch Pfizer/BioNTech Study Found Lipid Nanoparticles Materials Outside Injection Site in Test Animals. judicialwatch.org. 2022. [(accessed on 12 July 2023)]. Available online: https://www.judicialwatch.org/nanoparticles-materials-outside-injection-site/
https://www.tga.gov.au/sites/default/files/foi-2389-06.pdf
Yang R, Deng Y, Huang B, Huang L, Lin A, Li Y, Wang W, Liu J, Lu S, Zhan Z, Wang Y, A R, Wang W, Niu P, Zhao L, Li S, Ma X, Zhang L, Zhang Y, Yao W, Liang X, Zhao J, Liu Z, Peng X, Li H, Tan W. A core-shell structured COVID-19 mRNA vaccine with favorable biodistribution pattern and promising immunity. Signal Transduct Target Ther. 2021 May 31;6(1):213. doi: 10.1038/s41392-021-00634-z. PMID: 34059617; PMCID: PMC8165147.
https://onlinelibrary.wiley.com/doi/10.1111/apm.13294
Roltgen, K.; Nielsen, S.C.A.; Silva, O.; Younes, S.F.; Zaslavsky, M.; Costales, C.; Yang, F.; Wirz, O.F.; Solis, D.; Hoh, R.A.; et al. Immune imprinting, breadth of variant recognition, and germinal center response in human SARS-CoV-2 infection and vaccination. Cell 2022, 185, 1025–1040.e14.
Vaccine mRNA Can Be Detected in Blood at 15 Days Post-Vaccination Biomedicines 2022, 10(7), 1538; https://doi.org/10.3390/biomedicines10071538
Low, J.M., Gu, Y., Ng, M.S.F. et al. Codominant IgG and IgA expression with minimal vaccine mRNA in milk of BNT162b2 vaccinees. npj Vaccines 6, 105 (2021). https://doi.org/10.1038/s41541-021-00370-z
Detection of Messenger RNA COVID-19 Vaccines in Human Breast Milk. Nazeeh Hanna, Ari Heffes-Doon, Xinhua Lin, Claudia Manzano De Mejia, Bishoy Botros, Ellen Gurzenda, Amrita Nayak. JAMA Pediatr. 2022 Dec; 176(12): 1268–1270. Published online 2022 Sep 26. doi: 10.1001/jamapediatrics.2022.3581
Krauson, A.J., Casimero, F.V.C., Siddiquee, Z. et al. Duration of SARS-CoV-2 mRNA vaccine persistence and factors associated with cardiac involvement in recently vaccinated patients. npj Vaccines 8, 141 (2023). https://doi.org/10.1038/s41541-023-00742-7
Alana F Ogata and others, Circulating Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) Vaccine Antigen Detected in the Plasma of mRNA-1273 Vaccine Recipients, Clinical Infectious Diseases, Volume 74, Issue 4, 15 February 2022, Pages 715–718, https://doi.org/10.1093/cid/ciab465
Cristoni Simone, Brogna Carlo, Frongillo Aquilino, Marino Giuliano, Montano Luigi, & Piscopo Marina. (2022). « Detection of recombinant spike protein in plasma from vaccinated against SARS-CoV-2 individuals ». (Version 1). Zenodo. https://doi.org/10.5281/zenodo.5831816
Cutting Edge: Circulating Exosomes with COVID Spike Protein Are Induced by BNT162b2 (Pfizer–BioNTech) Vaccination prior to Development of Antibodies: A Novel Mechanism for Immune Activation by mRNA Vaccines
Sandhya Bansal et al. J Immunol (2021) 207 (10): 2405–2410.
https://www.sciencedirect.com/science/article/pii/S0092867422000769
Cognetti JS, Miller BL. Monitoring Serum Spike Protein with Disposable Photonic Biosensors Following SARS-CoV-2 Vaccination. Sensors (Basel). 2021 Aug 31;21(17):5857. doi: 10.3390/s21175857. PMID: 34502753; PMCID: PMC8434114.
Appelbaum J, Arnold DM, Kelton JG, Gernsheimer T, Jevtic SD, Ivetic N, Smith JW, Nazy I. SARS-CoV-2 spike-dependent platelet activation in COVID-19 vaccine-induced thrombocytopenia. Blood Adv. 2022 Apr 12;6(7):2250-2253. doi: 10.1182/bloodadvances.2021005050. PMID: 34724709; PMCID: PMC8563079.
https://www.ahajournals.org/doi/full/10.1161/CIRCULATIONAHA.122.061025
Persistent varicella zoster virus infection following mRNA COVID-19 vaccination was associated with the presence of encoded spike protein in the lesion. Mayuko Yamamoto MD, PhD, Misaki Kase MD, Hozumi Sano MD, Reiko Kamijima, Shigetoshi Sano MD, PhD. First published: 25 August 2022. https://doi.org/10.1002/cia2.12278
A case of persistent, confluent maculopapular erythema following a COVID-19 mRNA vaccination is possibly associated with the intralesional spike protein expressed by vascular endothelial cells and eccrine glands in the deep dermis. Hozumi Sano, Misaki Kase, Yukiko Aoyama, Shigetoshi San
Mörz, M. A Case Report: Multifocal Necrotizing Encephalitis and Myocarditis after BNT162b2 mRNA Vaccination against COVID-19. Vaccines 2022, 10, 1651. https://doi.org/10.3390/vaccines10101651
https://www.europeanreview.org/wp/wp-content/uploads/013-019-2.pdf
Jusqu’ à 50% d’ARNm incomplets codant pour une protéine spike défectueuse
Quality Rolling Review CHMP overview and List of Questions . EMA / CHMP/64856/2020.
https://www.ema.europa.eu/en/documents/assessment-report/comirnaty-epar-public-assessment-report_en.pdf
Des taux résiduels d’ADN plasmidique au-delà des seuils réglementaires sur certains lots et la présence d’une séquence du virus oncogène SV40
[Palmer, M., Gilthorpe, J. (2023) COVID-19 mRNA vaccines contain excessive quantities of bacterial DNA: evidence and implications. Doctors for COVID Ethics. Retrieved from https://doctors4covidethics.org/covid-19-mrna-vaccines-contain-excessive-quantities-of-bacterial-dna-evidence-and-implications/
McKernan, K., Helbert, Y., Kane, L.T., McLaughlin, S. (2023) Sequencing of bivalent Moderna and Pfizer mRNA vaccines reveals nanogram to microgram quantities of expression vector dsDNA peer dose. ResearchGate. doi: 10.31219/osf.io/b9t7m. Retrieved from https://www.researchgate.net/publication/369967228_Sequencing_of_bivalent_Moderna_and_Pfizer_mRNA_vaccines_reveals_nanogram_to_microgram_quantities_of_expression_vector_dsDNA_per_dose
Buckhaults, P. (2023) Testimony before South Carolina Senate Medical Affairs Ad-Hoc Committee on DHEC. Retrieved from https://www.youtube.com/watch?v=IEWHhrHiiTY
Spieicher, D., (2023) dsDNA contamination in the mRNA vaccines, quantity, reproducibility and implications. David Speicher substack. Retrieved from https://substack.com/@drdavidspeicher
https://osf.io/b9t7m/
https://youtu.be/IEWHhrHiiTY
https://twitter.com/i/status/1654413127415480320
https://osf.io/mjc97/
König, B.; Kirchner, J.O. Methodological Considerations Regarding the Quantification of DNA Impurities in the COVID-19 mRNA Vaccine Comirnaty®. Methods Protoc. 2024, 7, 41. https://doi.org/10.3390/mps7030041
La Spike est une molécule toxique notamment proinflammatoire, prothrombogène, amyloide :
Jean-François Lesgards, Dominique Cerdan, Christian Perronne, Jean-Marc Sabatier, Xavier Azalbert, Elizabeth A. Rodgers, Peter A. McCullough. Toxicity of SARS-CoV-2 Spike Protein from the Virus and Produced from COVID-19 mRNA or Adenoviral DNA Vaccines. Archives of Microbiology and Immunology. 7 (2023): 121- 138.
Cosentino, M.; Marino, F. Understanding the Pharmacology of COVID-19 mRNA Vaccines: Playing Dice with the Spike? Int. J. Mol. Sci. 2022, 23, 10881. https://doi.org/10.3390/ijms231810881
Shen CJ, Lin YP, Chen WC, Cheng MH, Hong JJ, Hu SY, Shen CF, Cheng CM. COVID-19 Vaccination in Pregnancy: Pilot Study of Plasma MicroRNAs Associated with Inflammatory Cytokines after COVID-19 mRNA Vaccination. Vaccines (Basel). 2024 Jun 14;12(6):658. doi: 10.3390/vaccines12060658. PMID: 38932387; PMCID: PMC11209245.
Un passage transplacentaire avec atteinte fœtale est démontré chez l’animal
mRNA-1273 is placenta-permeable and immunogenic in the fetus Chen, Jeng-Chang et al. Molecular Therapy Nucleic Acids, Volume 36, Issue 1, 102489
Un passage dans le lait maternel est démontré chez la femme
Low, J.M., Gu, Y., Ng, M.S.F. et al. Codominant IgG and IgA expression with minimal vaccine mRNA in milk of BNT162b2 vaccinees. npj Vaccines 6, 105 (2021). https://doi.org/10.1038/s41541-021-00370-z
Detection of Messenger RNA COVID-19 Vaccines in Human Breast Milk
Nazeeh Hanna, Ari Heffes-Doon, Xinhua Lin, Claudia Manzano De Mejia, Bishoy Botros, Ellen Gurzenda, Amrita Nayak. JAMA Pediatr. 2022 Dec; 176(12): 1268–1270. Published online 2022 Sep 26. doi: 10.1001/jamapediatrics.2022.3581
Aucune étude de génotoxicité ni de carcinogénicité alors que le risque d’intégration génomique est reconnu par le TGA
https://www.ema.europa.eu/en/documents/assessment-report/comirnaty-epar-public-assessment-report_en.pdf
https://www.tga.gov.au/sites/default/files/2024-12/FOI%2025-0058%20Documents.pdf
Référence sur les effets indésirables
https://ansm.sante.fr/dossiers-thematiques/covid-19-vaccins
https://www.ema.europa.eu/en/human-regulatory-overview/public-health-threats/coronavirus-disease-covid-19/covid-19-public-health-emergency-international-concern-2020-23/guidance-medicine-developers-other-stakeholders-covid-19/covid-19-guidance-post-authorisation
Références sur les défauts majeurs d’efficacité
https://www.ema.europa.eu/en/medicines/human/EPAR/comirnaty
https://www.fda.gov/media/152256/download
https://www.fda.gov/media/144416/download
https://phmpt.org/wp-content/uploads/2022/04/reissue_5.3.6-postmarketing-experience.pdf
Signataires:
Médecins et universitaires:
Dr Philippe de Chazournes, Docteur en Médecine, Médecin généraliste
Dr Claude Escarguel, Docteur en Pharmacie, Microbiologiste, Président de l’UPGCS
Dr Louis Fouché, Docteur en Médecine, Anesthésiste-Réanimateur
Dr Hélène Banoun, Docteur en Pharmacie, Microbiologiste
Dr Christian Vélot, Docteur en Biologie moléculaire, Généticien
Pr Christian Perronne, PuPH, Infectiologue
Laurent Mucchielli, sociologue, Directeur de recherche au CNRS
Dr Anne Catherine Martin, Docteur en Médecine
Dr Christian Latriche, Docteur en Médecine
Dr Laurent Hervieux, Docteur en Médecine
Pr Bernard Massie, PhD Microbiologie et Immunologie
Dr Françoise Auban, Docteur en Médecine
Dr Michel Pontis, Docteur en Médecine
Dr Evelyne Rougeaux, Docteur en Médecine
Dr Carine Caron, Docteur en Médecine
Dr Jean Pierre Garcia, Docteur en Médecine
Dr Dominique Rueff, Docteur en Médecine
Dr Bernard Saussol, Docteur en Médecine
Dr Edouard Broussalian, Docteur en Médecine
Dr Eric Kiener, Docteur en Médecine
Dr Dominique Prost, Docteur en Médecine
Dr Sébastien Brunet, Docteur en Médecine
Dr Eric Loridan, Docteur en Médecine, Chirurgien général
Dr Pauline De vaux, Docteur en Médecine, Psychiatre
Dr Marie Dominique Petit, Docteur en Médecine
Dr Noyan Handé, Docteur en Médecine
Dr Michel Boudé, Docteur en Médecine
Dr Catherine Guiffra, Docteur en Médecine
Dr Elisabeth Grimaud, Docteur en Psychologie
Dr Sophie Scheffer, Docteur en Médecine
Dr Catherine Noël, Docteur en Médecine
Dr Claire Lenclud, Docteur en Médecine
Dr Line Cabot, Docteur en Médecine
Dr Alain Joseph, Docteur en Médecine
Dr Pierre Maugeais, Docteur en Médecine
Dr Pascale Brun, Docteur en Médecine
Dr Clotilde Véron, Docteur en Médecine
Dr Michel Procureur, Docteur en Médecine
Dr Edwige Bertin, Docteur en Médecine
Collectifs et associations:
Les Enfants D’Hippocrate
Conseil Scientifique Indépendant
AAVIC Team
RéinfoLiberté
Collectif Santé Mauges